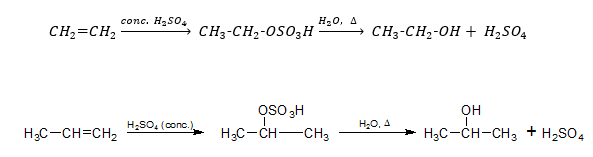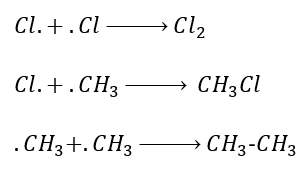খ. অ্যালকাইন থেকে: Pd এবং BaSO4 এর উপস্থিতিতে H2 দ্বারা ইথাইন কে বিজারিত করলে ইথিন উৎপন্ন হয়।
(উৎপন্ন ইথিন যাতে পুনরায় বিজারিত হয়ে ইথেনে পরিণত হতে না পারে তাই ইথানের বিজারণ নিয়ন্ত্রন করার জন্য BaSO4 যুক্ত Pd প্রভাবক ব্যবহার করা হয়।)
গ. অ্যালকাইল হ্যালাইড থেকে হাইড্রোজেন হ্যালাইড অপসারণ: অ্যালকাইল হ্যালাইডকে অ্যালকোহলীয় কস্টিক সোডা (NaOH) বা কস্টিক পটাশ (KOH) দ্বারা উত্তপ্ত করা হলে যৌগ থেকে HX এর অপসারণ ঘটে এবং অ্যালকিন উৎপন্ন হয়।
ঘ. সন্নিহিত ডাই-হ্যালাইডের হ্যালোজেন অপসারণ: সন্নিহিত ডাই-হ্যালাইডকে জিংক চূর্ণসহ উত্তপ্ত করা হলে যৌগ থেকে হ্যালোজেন অপসারিত হয়ে অ্যালকিন উৎপন্ন হয়।
অ্যালকিনের বিক্রিয়া-
অ্যালকিনে অস্থায়ী দ্বিবন্ধন থাকায় এরা অত্যন্ত সক্রিয়। অ্যালকিনের বিক্রিয়া সমূহ দ্বিবন্ধনে ঘটে থাকে। এরা সংযোজন, জারন, ওজোনীকরণ, পলিমারকরণ ইত্যাদি বিক্রিয়া দেয়।
অ্যালকিনের সংযোজন বিক্রিয়া-
হাইড্রোজেন (H2), হ্যালোজেন (X2), হাইড্রোজেন হ্যালাইড (HX), হাইপো হ্যালাস এসিড (HOX), সালফিউরিক এসিড (H2SO4), ওজোন (O3) প্রভৃতি বিকারক অ্যালকিনের কার্বন-কার্বন দ্বিবন্ধনের সঙ্গে যুত বিক্রিয়ার মাধ্যমে যুত যৌগ উৎপন্ন করে। যেমন:
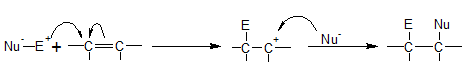
অ্যালকিনের সংযোজন বিক্রিয়া মূলত ইলেকট্রোফিলিক সংযোজন বিক্রিয়া। অ্যালকিনের কার্বন-কার্বন দ্বিবন্ধনে সঞ্চারণশীল পাই (π) ইলেকট্রনের মেঘ সহজেই ধনাত্মক ইলেকট্রন আকর্ষী বিকারক তথা ইলেকট্রোফাইল (E+) দ্বারা আক্রান্ত হয়। ইলেকট্রন আকর্ষী বিকারকের আকর্ষনে π-ইলেকট্রন মেঘমালা আক্রান্ত কার্বন পরমাণুতে স্থানান্তরিত হয়। এবং এই ইলেকট্রন দ্বারা কার্বন পরমাণুটির সঙ্গে ইলেকট্রন আকর্ষী বিকারক (E+) যুক্ত হয়। π-ইলেকট্রন একটি কার্বন পরমাণুতে স্থানান্তরিত হওয়ায় অপর কার্বন পরমাণুটি ধনাত্মক চার্জযুক্ত হয়। ফলে ক্ষণস্থায়ী কার্বোনিয়াম আয়ন (C+) সৃষ্টি হয় যা অত্যন্ত দ্রুতগতিতে বিকারক অনুর ঋণাত্মক (Nu-) অংশের সাথে যুক্ত হয়ে যুত যৌগ গঠন করে।
H2 সংযোজন: Pt, Pd বা Ni প্রভাবকের উপস্থিতিতে অ্যালকিনের সঙ্গে হাইড্রোজেন যুক্ত হয়ে অ্যালকেন উৎপন্ন হয়।
H2 সংযোজন কৌশল মূলত প্রভাবকীয় সংযোজন। প্রথমে Ni ধাতুর উপর H2 অধিশোষিত হয়। Ni ধাতুর পৃষ্ঠতলের পরমাণুসমূহ অধিশোষিত H পরমাণুর সাথে বন্ধন তৈরী করে। পরবর্তীতে H পরমাণুর সাথে ইথিন অন্তরবর্তী জটিল যৌগ গঠন করে সবশেষে উৎপাদ তৈরী করে।
HX সংযোজন : হাইড্রোজেন হ্যালাইডের এর সঙ্গে অ্যালকিনের যুত বিক্রিয়ায় অ্যালকাইল হ্যালাইড উৎপন্ন হয়।
HX সংযোজন কৌশল:
১ম ধাপ: অ্যালকিনের সঞ্চারণশীল π-ইলেকট্রন HX-এর প্রোটন এর সাথে বন্ধনের মাধ্যমে ক্ষনস্থায়ী কার্বোনিয়াম আয়ন ও হ্যালাইড আয়ন উৎপন্ন করে। এই ধাপটি ধীর গতির।

২য় ধাপ: প্রথম ধাপে উৎপন্ন কার্বোনিয়াম আয়ন অত্যন্ত দ্রুত গতিতে নিকটস্থ হ্যালাইড আয়নের সাথে যুক্ত হয়ে অ্যালকাইল হ্যালাইড উৎপন্ন করে।
X2 সংযোজন: সাধারণ তাপমাত্রায় হ্যালোজেন অ্যালকিনের সঙ্গে বিক্রিয়া করে সন্নিহিত ডাই-হ্যালাইড উৎপন্ন করে।
Br2 সংযোজন কৌশল:
HOX সংযোজন: হাইপোহ্যালাস এসিড অ্যালকিনের সাথে বিক্রিয়া করে হ্যালোহাইড্রিন উৎপন্ন করে।
HOCl সংযোজন কৌশল:
H2SO4 সংযোজন: কক্ষ তাপমাত্রায় অ্যালকিনের সাথে গাঢ় H2SO4 –এর বিক্রিয়ায় অ্যালকাইল হাইড্রোজেন সালফেট উৎপন্ন করে, যা আর্দ্র বিশ্লেষিত হয়ে অ্যালকোহল উৎপন্ন হয়। এ বিক্রিয়ার সাহায্যে অ্যালকিন থেকে অধিক পরিমাণে অ্যালকোহল প্রস্তুত করা যায়।
ওজোন সংযোজন বা ওজোনীকরণ: ক্লোরোফরম (CHCl3) বা কার্বন টেট্রাক্লোরাইড (CCl4) –এ দ্রবীভূত অ্যালকিনের শীতল দ্রবণে ওজোন গ্যাস চালনা করলে দ্বিবন্ধনে এক অণু ওজোন যুক্ত হয়ে ওজোনাইড নামক যুত যৌগ উৎপন্ন করে। উৎপন্ন ওজোনাইড যৌগকে আর্দ্র বিশ্লেষণ করা হলে অ্যালকিনের গঠন ও দ্বিবন্ধনের অবস্থান অনুযায়ী অ্যালডিহাইড বা কিটোন ও H2O2 উৎপন্ন হয়। তাই এই বিক্রিয়ার মাধ্যমে দ্বিবন্ধনের অবস্থান নির্ণয় করা যায়। উৎপন্ন H2O2 এর উপস্থিতিতে অ্যালডিহাইড পুনরায় বিজারিত হয়ে কার্বক্সিলিক এসিডে পরিণত হওয়া রোধ করার জন্য Zn গুড়া যোগ করা হয়।
জৈব যৌগের সংযোজন বিক্রিয়ার মারকনিকভ নিয়ম:
অপ্রতিসম অসম্পৃক্ত জৈব যৌগের সাথে অপ্রতিসম অসম্পৃক্ত বিকারকের সংযোজন বিক্রিয়ায় বিকারক অণুর ঋণাত্মক অংশ সাধারণত কম সংখ্যক হাইড্রোজেন পরমাণু বিশিষ্ট অসম্পৃক্ত কার্বন (π-বন্ধনযুক্ত কার্বন) পরমাণুতে যুক্ত হয়। এটি মারকনিকভ নিয়ম নামে পরিচিত।
যেমন অপ্রতিসম অসম্পৃক্ত জৈব যৌগ প্রোপিনের (CH3-CH=CH2) সাথে অপ্রতিসম বিকারক হাইড্রোজেন হ্যালাইড ( যেমন: HBr) -এর বিক্রিয়ায় ঋণাত্মক হ্যালাইড আয়ন কম সংখ্যক হাইড্রোজেন পরমাণু বিশিষ্ট অসম্পৃক্ত কার্বনে যুক্ত হয়। তাই মারকনিকভ নিয়ম অনুসারে প্রোপিনের সাথে HBr –এর সংযোজন বিক্রিয়ায় ২-ব্রোমোপ্রোপেন প্রধান উৎপাদ পাওয়া যাবে।
উপরের উদাহরণে ২-নং অসম্পৃক্ত কার্বনে কম সংখ্যক (১-টি) হাইড্রোজেন পরমাণু আছে। তাই বিকারক অনুর ঋণাত্মক অংশ এই কার্বন (২-নং কার্বন) পরমাণুটির সাথে যুক্ত হয়ে প্রধান উৎপাদ ২-ব্রোমোপ্রোপেন উৎপন্ন করেছে।
এর কারণ হচ্ছে বিক্রিয়াটি ইলেকট্রোফিলিক সংযোজন কৌশল অনুসারে ঘটে। ফলে এতে ১০ ও ২০ কার্বোনিয়াম আয়ন উৎপন্ন হয়। আর আমরা জানি ২০ কার্বোনিয়াম আয়ন ১০ কার্বোনিয়াম আয়নের চেয়ে অধিক সুস্থিত। তাই ২-ব্রোমোপ্রোপেন অধিক পরিমাণে উৎপন্ন হয়।
বিপরীত মারকনিক্ভ নিয়ম:
স্বল্প পরিমাণ জৈব পারঅক্সাইড এর উপস্থিতিতে অপ্রতিসম অসম্পৃক্ত জৈব যৌগের সাথে অপ্রতিসম অসম্পৃক্ত বিকারকের সংযোজন বিক্রিয়ায় বিকারক অণুর ঋণাত্মক অংশ সাধারণত অধিক সংখ্যক হাইড্রোজেন পরমাণু বিশিষ্ট অসম্পৃক্ত কার্বন (π-বন্ধনযুক্ত কার্বন) পরমাণুতে যুক্ত হয়। একে খারাশের পার-অক্সাইড প্রভাব বা বিপরীত মারকনিকভ নিয়ম বলে।
যেমন জৈব পারঅক্সাইডের উপস্থিতিতে প্রোপিনের সাথে HBr -এর বিক্রিয়ায় 99.1% ১- ব্রোমোপ্রোপোন ও 0.9% ২- ব্রোমোপ্রোপেন উৎপন্ন হয়।
উপরের উদাহরণে ৩-নং অসম্পৃক্ত কার্বনে অধিক সংখ্যক (২-টি) হাইড্রোজেন পরমাণু আছে। তাই পারঅক্সাইড (RO-OR) -এর উপস্থিতিতে বিকারক অনুর ঋণাত্মক অংশ এই কার্বন (৩-নং কার্বন) পরমাণুটির সাথে যুক্ত হয়ে প্রধান উৎপাদ ১-ব্রোমোপ্রোপেন উৎপন্ন করেছে।
এর কারণ হচ্ছে, জৈব পার-অক্সাইডের উপস্থিতিতে প্রোপিনে HBr সংযোজন মূলত ফ্রী- রেডিকেল মেকানিজম অনুসারে ঘটে। নিম্নে পার-অক্সাইড প্রভাবের ক্রিয়া কৌশল দেখানো হল-
১ম ধাপ: এ ধাপে জৈব-পারঅক্সাইডের উপস্থিতিতে ব্রোমিন ফ্রী- রেডিকেল উৎপন্ন হয়।
২য় ধাপ: উৎপন্ন ব্রোমিন ফ্রী- রেডিকেল প্রোপিনকে আক্রমন করে অধিকতর স্থায়ী ২০ ব্রোমো অ্যালকাইল ফ্রী- রেডিকেল উৎপন্ন করে।
৩য় ধাপ: এই ২০ ব্রোমো অ্যালকাইল ফ্রী- রেডিকেল HBr –এর সাথে বিক্রিয়ায় বিপরীত মারকনিকভ উৎপাদ ও Br● উৎপন্ন করে যা আবার প্রোপিনের সাথে বিক্রিয়া করে।
অ্যালকিনের জারন বিক্রিয়া:
অ্যালকিন ও ক্ষারীয় শীতল লঘু KMnO4 এর জলীয় দ্রবণ এর জারণ বিক্রিয়ায় দ্বিবন্ধন এ দুটি -OH মূলক যুক্ত হয়ে গ্লাইকল উৎপন্ন করে। এ বিক্রিয়ার ফলে KMnO4 গোলাপী বর্ণ দূরীভুত হয় বলে এ বিক্রিয়া দ্বারা অ্যালকিন শনাক্তকরণ তথা দ্বিবন্ধনের উপস্থিতি নির্ণয় তথা জৈব যৌগের অসম্পৃক্ততা নির্নয় করা যায়।
জৈব যৌগের অসম্পৃক্ততা নির্ণয়:
ব্রোমিন পানি পরীক্ষা (Br2 সংযোজন):
অ্যালকিনের সাথে ও Br2 এর সংযোজন বিক্রিয়ায় সন্নিহিত ডাই-হ্যালাইড উৎপন্ন হয়। যেমন: ইথিন (CH2=CH2) ও Br2 এর বিক্রিয়ায় ১,২-ডাইব্রোমো ইথেন উৎপন্ন হয়।
অ্যালকেন এ বিক্রিয়া দেয় না। এ বিক্রিয়ায় ব্রোমিনের লাল বর্ণের জলীয় দ্রবন দূরীভুত হয় বলে এ বিক্রিয়ার সাহায্যে জৈব যৌগে দ্বিবন্ধনের উপস্থিতি নির্ণয় করা বা অসম্পৃক্ততার পরীক্ষা করা যায়।
অ্যালকিনের জারণ:
অ্যালকিন ও লঘু ক্ষারীয় KMnO4 এর বিক্রিয়ায় সন্নিহিত ডাই-অল উৎপন্ন হয়। যেমন: যেমন: ইথিন (CH2=CH2) ও ক্ষারীয় KMnO4 এর বিক্রিয়ায় ইথেন ১,২-ডাইঅল বা ইথিলিন গ্লাইকল উৎপন্ন হয়।
অ্যালকেন এ বিক্রিয়া দেয় না। এ বিক্রিয়ায় KMnO4 এর গোলাপী বর্ণ দূরীভুত হয় বলে এ বিক্রিয়ার সাহায্যে জৈব যৌগে দ্বিবন্ধনের উপস্থিতি নির্ণয় করা বা অসম্পৃক্ততার পরীক্ষা করা যায়।
জৈব যৌগে দ্বিবন্ধনের অবস্থান নির্ণয়:
ক্লোরোফরম (CHCl3) বা কার্বন টেট্রাক্লোরাইড (CCl4) –এ দ্রবীভূত অ্যালকিনের শীতল দ্রবণে ওজোন গ্যাস চালনা করলে দ্বিবন্ধনে এক অণু ওজোন যুক্ত হয়ে ওজোনাইড নামক যুত যৌগ উৎপন্ন করে। উৎপন্ন ওজোনাইড যৌগকে আর্দ্র বিশ্লেষণ করা হলে অ্যালকিনের গঠন ও দ্বিবন্ধনের অবস্থান অনুযায়ী অ্যালডিহাইড বা কিটোন ও H2O2 উৎপন্ন হয়। তাই এই বিক্রিয়ার মাধ্যমে দ্বিবন্ধনের অবস্থান নির্ণয় করা যায়। উৎপন্ন H2O2 এর উপস্থিতিতে অ্যালডিহাইড পুনরায় বিজারিত হয়ে কার্বক্সিলিক এসিডে পরিণত হওয়া রোধ করার জন্য Zn গুড়া যোগ করা হয়।