কপার ও ক্রোমিয়াম এর ইলেকট্রন বিন্যাস নিম্নরূপঃ
মুক্তজোড় ইলেকট্রনঃ কোন পরমাণুর যোজ্যতা স্তরে বা সর্ববহিঃস্থ শক্তিস্তরে যে ইলেকট্রন গুলো বন্ধন গঠনে অংশগ্রহণ করে না তাদেরকে মুক্তজোড় ইলেকট্রন বলে।
এখানে, ক্লোরিনের সর্ববহিঃস্থ শক্তিস্তর অর্থাৎ তৃতীয় শক্তিস্তরে 3s² 3Px² 3Py² অরবিটাল গুলোতে দুটি করে ইলেকট্রন বিদ্যমান থাকে। এই ইলেকট্রনগুলি বন্ধন গঠনে অংশগ্রহণ করে না। এজন্য এই ইলেকট্রনগুলি কে মুক্তজোড় ইলেকট্রন বলে। এখানে ক্লোরিনের তিন জোড়া মুক্তজোড় ইলেকট্রন আছে।
বন্ধন জোড় ইলেকট্রনঃ পরমাণু যোজ্যতা স্তরে বা সর্ববহিঃস্থ শক্তিস্তরে যে ইলেকট্রনগুলি বন্ধন গঠনে অংশগ্রহণ করে তাদেরকে বন্ধন জোড় ইলেকট্রন বলে।
কোন পরমাণু ইলেকট্রন বিন্যাস করলে তার সর্ববহিঃস্থ শক্তিস্তরে যে বেজোড় ইলেকট্রন গুলি থাকে সেই ইলেকট্রনগুলি বন্ধন গঠনে অংশগ্রহণ করে। কাজেই বলা যায়, কোন পরমাণুর সর্ববহিঃস্থ শক্তিস্তরে যতটি বেজোড় ইলেকট্রন থাকে ঐ পরমাণু ততটি বন্ধন গঠন করতে পারে।
এখানে, ক্লোরিনের সর্ববহিঃস্থ শক্তিস্তর অর্থাৎ তৃতীয় শক্তিস্তরে 3Pz¹ অরবিটালে একটি বেজোড় ইলেকট্রন বিদ্যমান থাকে। এই ইলেকট্রন বন্ধন গঠনে অংশগ্রহণ করে। এজন্য এই ইলেকট্রনকে বন্ধন জোড় ইলেকট্রন বলে।
আউফবাউ নীতি অনুসারে ইলেকট্রন প্রথমে নিম্ন শক্তির অরবিটালে এবং পরে উচ্চ শক্তির অরবিটালে গমন করে।
দুটি অরবিটালের মধ্যে কোনটি নিম্ন শক্তির আর কোনটি উচ্চ শক্তির তা প্রধান কোয়ান্টাম সংখ্যা ও সহকারী কোয়ান্টাম সংখ্যা (n + l) এর মানের যোগফলের উপর নির্ভর করে। যার (n + l) এর মান কম সেটি নিম্নশক্তির অরবিটাল এবং (n + l) এর মান বেশি হলে সেটি উচ্চশক্তির অরবিটাল।
3d অরবিটালে ঃ n=3, l = 2 হলে,
(n + l)= 3+2= 5.
(n + l)= 4+0= 4 .
সুতরাং 3d এর চেয়ে 4s অরবিটালের শক্তি কম হওয়ায় পটাশিয়ামের 19 তম ইলেকট্রন 3d অরবিটালে না গিয়ে 4s অরবিটালের যায়।
K (19) --> 1s² 2s² 2p⁶ 3s² 3p⁶ 4s¹
কিছু অ্যালকেনের নাম ও আনবিক সংকেত দেওয়া হলঃ
মিথেন(CH₄), ইথেন (C₂H₆), প্রোপেন (C₃H₈), বিউটেন (C₄H₁₀), পেন্টেন (C₅H₁₂), হেক্সেন (C₆H₁₄), হেপ্টেন (C₇H₁₆), অকটেন (C₈H₁₈), ননেন (C₉H₂₀), ডেকেন(C₁₀H₂₂) উনডেকেন (C₁₁H₂₄), ডোডেকেন(C₁₂H₂₆), ট্রাইডেকেন (C₁₃H₂₈), টেট্রাডেকেন (C₁₄H₃₀), পেন্টাডেকেন (C₁₅H₃₂), হেক্সাডেকেন (C₁₆H₃₄), হেপ্টাডেকেন (C₁₇H₃₆), অক্টাডেকেন (C₁₈H₃₈), ননাডেকেন (C₁₉H₄₀), ইকোসেন (C₂₀H₄₂), উনকোসেন (C₂₁H₄₄), ডোকোসেন (C₂₂H₄₆), ট্রাইকোসেন (C₂₃H₄₈), ইত্যাদি।
প্রশ্ন:- একটি জৈব গ্রিনহাউস গ্যাসের [Greenhouse Gas] নাম কী ?
উত্তর:- একটি জৈব গ্রিনহাউস গ্যাসের নাম হল মিথেন (CH4) ।
প্রশ্ন:- প্রোপান্যালের সমাবয়বী একটি যৌগের নাম কি ?
উত্তর:- প্রোপান্যালের (CH3CH2CHO) সমাবয়বী একটি যৌগের নাম হল অ্যাসিটোন বা প্রোপানোন (CH3-CO-CH3) ।
প্রশ্ন:- অ্যালকিনের [Alkenes] সাধারণ সংকেত কী ?
উত্তর:- অ্যালকিনের সাধারণ সংকেত হল CnH2n, যেখানে nধনাত্বক পূর্ণসংখ্যা ।
প্রশ্ন:- মিথানল অ্যাসিডে উপস্থিত কার্যকরী গ্রুপের সংকেত কী ?
উত্তর:- মিথানল অ্যাসিডে উপস্থিত কার্যকরী গ্রুপ হল অ্যালকোহলীয় হাইড্রক্সিল গ্রুপ (–OH) ।
প্রশ্ন:- ইথানোয়িক অ্যাসিডে উপস্থিত কার্যকরী গ্রুপের সংকেত কী ?
উত্তর:- ইথানোয়িক অ্যাসিডে উপস্থিত কার্যকরী গ্রুপ হল কার্বক্সিলিক অ্যাসিড গ্রুপ (–COOH) ।
প্রশ্ন:- দুটি হাইড্রোজেন পরমাণুযুক্ত একটি হাইড্রোকার্বনের গঠন লেখো ।
উত্তর:- দুটি হাইড্রোজেন পরমাণুযুক্ত একটি হাইড্রোকার্বন হল অ্যাসিটিলিন এবং এর গঠন সংকেত হল H–C = C–H ।
প্রশ্ন:- সরলতম হাইড্রোকার্বনের নাম কী ?
উত্তর:- সরলতম হাইড্রোকার্বনের নাম হল মিথেন (CH4) ।
প্রশ্ন:- আলেয়া (Will-O-the-Wisp) সৃষ্টিতে কোন গ্যাসটির ভুমিকা আছে ?
উত্তর:- আলেয়া সৃষ্টিতে মিথেন (CH4) গ্যাসটির ভুমিকা আছে ।
প্রশ্ন:- তিনটি কার্বন পরামাণুযুক্ত অ্যালকেনে হাইড্রোজেন পরমাণুর সংখ্যা কত ?
উত্তর:- অ্যালকেনের সাধারণ সংকেত হল CnH2n+2 , যেখানে ‘n’ কার্বন পরমাণুর সংখ্যা । অতএব 3 টি কার্বন পরমাণুযুক্ত অ্যালকেনে H– পরমাণুর সংখ্যা = (2.3 + 2) = 8 ।
প্রশ্ন:- পলিমার কী ?
উত্তর:- একই বা ভিন্ন যৌগের বহু সংখ্যাক সরল অণুর সংযোগে গঠিত উচ্চ আণবিক ভর বিশিষ্ট যৌগকে পলিমার বলে ।
প্রশ্ন:- অজৈব যৌগ থেকে প্রস্তুত প্রথম জৈব যৌগটির [OrganicCompound] নাম কী ?
উত্তর:- অজৈব যৌগ [Inorganic Compound] থেকে প্রস্তুত প্রথম জৈব যৌগটির নাম হল ইউরিয়া ।
প্রশ্ন:- কোন বিজ্ঞানী সর্বপ্রথম অজৈব যৌগ থেকে ইউরিয়া (জৈব যৌগ) আবিষ্কার করেন ?
উত্তর:- 1828 সালে জার্মান বিজ্ঞানী ফ্রেডরিক ভোলহারসর্বপ্রথম অজৈব যৌগ অ্যামোনিয়াম সায়ানেট (NH4CNO) থেকে জৈব যৌগ ইউরিয়া [CO(NH2)2] প্রস্তুত করেন ।
যথা :
ইউরিয়া একটি প্রকৃতিজাত জৈব পদার্থ, যা স্তন্যপায়ীর মূত্রে পাওয়া যায় ।
প্রশ্ন:- প্রথম কোন জৈব যৌগ [Oorganic Compound] সংশ্লেষিত হয় ? এটি কে আবিষ্কার করেন ?
উত্তর:- প্রথম যে জৈব যৌগটি সংশ্লেষিত হয়, তা হল অ্যাসিটিক অ্যাসিড (CH3COOH) । 1845 সালে বিজ্ঞানী কোলবেপরীক্ষাগারে কার্বন, হাইড্রোজেন ও অক্সিজেন ঘটিত এই জৈব যৌগটি প্রস্তুত করেন ।
প্রশ্ন:- জৈব যৌগগুলি তড়িৎযোজী না সমযোজী পদার্থ ?
উত্তর:- জৈব যৌগগুলি হল সমযোজী পদার্থ ।
প্রশ্ন:- কোন ধর্মের জন্য কার্বন পরমাণু নিজেদের মধ্যে দীর্ঘ শৃঙ্খল তৈরি করে ?
উত্তর:- ক্যাটিনেশন বা শৃঙ্খলায়ন ধর্মের জন্য কার্বন পরমাণু নিজেদের মধ্যে দীর্ঘ শৃঙ্খল তৈরি করে ।
প্রশ্ন:- নীচের যৌগগুলির মধ্যে কোন গুলি জৈব যৌগ ?
NaHCO3, CH4, CO2, CHCl3, CaC2
উত্তর:- CH4 এবং CHCl3 হল জৈব যৌগ ।
প্রশ্ন:- কার্বাইড গ্যাস বাতিতে যে গ্যাসটি জ্বলে তার নাম কী ?
উত্তর:- কার্বাইড গ্যাস বাতিতে যে গ্যাসটি জ্বলে তার নাম হলঅ্যাসিটিলিন (C2H2) ।
প্রশ্ন:- মিথেন [Methane] প্রস্তুতির প্রারম্ভিক দ্রব্যগুলি কী কী ?
উত্তর:- মিথেন প্রস্তুতির প্রারম্ভিক দ্রব্যগুলি হল শুষ্ক সোডিয়াম অ্যাসিটেট এবং সোডালাইম ।
যথা:-
প্রশ্ন:- ফল পাকাতে কোন গ্যাস ব্যবহার করা হয় ?
উত্তর:- ফল পাকাতে ইথিলিন [Ethylene] গ্যাস ব্যবহার করা হয় ।
প্রশ্ন:- ঝালাইয়ের কাজে যে দুটি গ্যাস ব্যবহার করা হয় তাদের নাম কী ?
উত্তর:- ঝালাইয়ের কাজে যে দুটি গ্যাস ব্যবহার করা হয় তা হলঅক্সিজেন ও অ্যাসিটিলিন ।
প্রশ্ন:- অ্যাসিটিলিনের উত্স কী ?
উত্তর:- স্বাভাবিক চাপে প্রায় 1500oC উষ্ণতায় প্রাকৃতিক গ্যাসকে উত্তপ্ত করে ঠান্ডা করলে মিথেন অ্যাসিটিলিনের পরিনত হয় ।
যথা:- 2CH4 = C2H2 + 3H2
এভাবে বর্তমানে C2H2 -এর পণ্য উত্পাদন করা হয় । কৃত্রিম রবার তৈরি করতে C2H2 ব্যবহৃত হয় ।
প্রশ্ন:- ইথেন অণুতে কার্বন-কার্বন এবং কার্বন-হাইড্রোজেন বন্ধনগুলি কী ধরনের ?
উত্তর:- ইথেন অণুতে কার্বন-কার্বন এক-বন্ধন দ্বারা এবং কার্বন-হাইড্রোজেন এক-বন্ধন দ্বারা যুক্ত থাকে ।
প্রশ্ন:- অ্যাসিটিলিন প্রস্তুতিতে প্রারম্ভিক দ্রব্যগুলি কী কী ?
উত্তর:- অ্যাসিটিলিন প্রস্তুতিতে প্রারম্ভিক দ্রব্যগুলি হলক্যালসিয়াম কার্বাইড ও জল ।
যথা:- CaC2 + 2H2O = Ca(OH)2 + C2H2 ↑ ।
প্রশ্ন:- কোন জৈব অ্যাসিডে কার্বলিক মূলক নেই ?
উত্তর:- কার্বলিক অ্যাসিডে (C6H5OH) কার্বলিক মূলক (–COOH) নেই ।
প্রশ্ন:- ইথিলিনের [Ethylene]একটি ব্যবহার উল্লেখ করো ।
উত্তর:- পলিথিন বা পলিইথিলিন [Polyethylene] প্লাস্টিকপ্রস্তুতিতে ইথিলিন ব্যবহৃত হয় ।
প্রশ্ন:- মার্স গ্যাস কী ?
উত্তর:- মার্স গ্যাস হল মিথেন (CH4) । কর্দমাক্ত জলাভূমিতে উদ্ভিদ ও জীবজন্তুর পচনের ফলে মিথেন গ্যাস উত্পন্ন হয় । তাই মিথেন [Methane] গ্যাসকে মার্স গ্যাস বলে ।
প্রশ্ন:- অ্যালকাইনের [Alkyne] সাধারণ সংকেত কী ?
উত্তর:- অ্যালকাইনের সাধারণ সংকেত হল CnH2n-2, যেখানে nধনাত্বক পূর্ণ সংখ্যা এবং ।
প্রশ্ন:- সরলতম অ্যালকেনের [Alkanes] নাম কী ?
উত্তর:- সরলতম অ্যালকেনের হল মিথেন [Methane] ।
প্রশ্ন:- অ্যাসিটিলিন কোন শ্রেণির জৈব যৌগ ?
উত্তর:- অ্যাসিটিলিন অ্যালকাইন শ্রেণির জৈব যৌগ ।
প্রশ্ন:- ইথাইল অ্যালকোহলের কার্যকরী মুলকের [Functional group] নাম কী ?
উত্তর:- ইথাইল অ্যালকোহলের কার্যকরী মুলকের নাম হলহাইড্রক্সিল (–OH) ।
প্রশ্ন:- অ্যাসিটোনের কার্যকরী মুলকের [Functional group] নাম কী ?
উত্তর:- অ্যাসিটোনের কার্যকরী মুলকের নাম হল কার্বনিল (> C = O) ।
প্রশ্ন:- পি. ভি. সি. (P.V.C.) পলিমারের মনোমার কী ?
উত্তর:- পি. ভি. সি. (P.V.C.) বা পলি-ভিনাইল ক্লোরাইড পলিমারের মনোমার হল ভিনাইল ক্লোরাইড (CH2 = CHCl) ।
প্রশ্ন:- টেফলনের [Teflon] মনোমার কী ?
উত্তর:- টেফলনের মনোমার হল ট্রেটাফ্লুওরো ইথিলিন (F2C =CF2) । এটি ফ্রাইং প্যান তৈরিতে ব্যবহার করা হয় ।
প্রশ্ন:- একটি জৈব বিনাশী কৃত্রিম পলিমারের নাম কী ?
উত্তর:- একটি জৈব বিনাশী কৃত্রিম পলিমার হলপলিহাইড্রক্সিবিউটারেট-বিটা হাইড্রক্সিভ্যালোরেট (P.H.B.V.) । এটি কয়েক মাসের মধ্যে প্রাকৃতিকভাবে বিনষ্ট হয় ।
প্রশ্ন:- একটি প্রাকৃতিক জৈব বিশ্লিষ্ট পলিমারের নাম কী ?
উত্তর:- খড়, তুলো, কাগজ প্রভৃতির মধ্যে থাকা সেলুলোজ হল একটি প্রাকৃতিক জৈব বিশ্লিষ্ট পলিমার ।
প্রশ্ন:- মিথেন অণুতে H—C—H বন্ধন কোণের মান কত ?
উত্তর:- মিথেন অণুতে H—C—H বন্ধন কোণের মান হল 109o28’ ।
প্রশ্ন:- দুটি সমাবয়বী যৌগের নাম লেখো ।
উত্তর:- দুটি সমাবয়বী যৌগের নাম হল : ইথাইল অ্যালকোহল(CH3CH2OH) এবং ডাই মিথাইল ইথার (CH3-O-CH3) ।
প্রশ্ন:- DNA -এর সম্পূর্ণ নাম কী ?
উত্তর:- DNA -এর সম্পূর্ণ নাম হল ডি-অক্সিরাইবো নিউক্লিক অ্যাসিড ।
প্রশ্ন:- RNA -এর সম্পূর্ণ নাম কী ?
উত্তর:- RNA -এর সম্পূর্ণ নাম হল রাইবোনিউক্লিক অ্যাসিড ।
প্রশ্ন:- কয়েকটি জীবজ অণুর নাম কী ?
উত্তর:- কয়েকটি জীবজ অণুর নাম হল কার্বোহাইড্রেট, প্রোটিন, ফ্যাট, নিউক্লিক অ্যাসিড প্রভৃতি ।
প্রশ্ন:- কার্বোহাইড্রেটে হাইড্রোজেন ও অক্সিজেন কী অনুপাতে থাকে ?
উত্তর:- কার্বোহাইড্রেটে হাইড্রোজেন ও অক্সিজেন 2 : 1 অনুপাতে থাকে ।
প্রশ্ন:- প্রোটিনের মনোমার কী ?
উত্তর:- প্রোটিনের মনোমার হল অ্যামিনো অ্যাসিড ।
প্রশ্ন:- নিউক্লিক অ্যাসিডে কোন অ্যাসিড থাকে ?
উত্তর:- নিউক্লিক অ্যাসিডে ফসফরিক অ্যাসিড (H3PO4) থাকে ।
প্রশ্ন:- DNA -তে কোন শর্করা থাকে ?
উত্তর:- DNA -তে 5-C যুক্ত ডি-অক্সিরাইবোজ শর্করা থাকে ।
প্রশ্ন:- RNA -তে কোন শর্করা থাকে ?
উত্তর:- RNA -তে 5-C যুক্ত রাইবোজ শর্করা থাকে ।
প্রশ্ন:- RNA - কয় প্রকার ও কী কী ?
উত্তর:- RNA - প্রধানত দুই প্রকার । যথা:- (i) জেনেটিক RNA এবং (ii) নন-জেনেটিক RNA ।
নন-জেনেটিক RNA আবার তিন প্রকার :-
(a) r-RNA বা রাইবোজোমাল RNA
(b) m-RNA বা মেসেঞ্জার (বার্তাবহ) RNA
(c) t-RNA বা ট্রান্সফার (পরিবৃত্তীয়) RNA ।
প্রশ্ন:- দুটি পলিস্যাকারাইডের নাম কী ?
উত্তর:- দুটি পলিস্যাকারাইডের নাম হল স্টার্চ বা শ্বেতসার এবংগ্লাইকোজেন ।
প্রশ্ন:- অ্যামিনো অ্যাসিড কী ?
উত্তর:- অ্যামিনো অ্যাসিড হল প্রোটিনের মনোমার । এটি একটি জৈব যৌগ, যার অণুতে অ্যামিনো মূলক (–NH2) এবং কার্বক্সিল মূলক (–COOH) উভয়ই বর্তমান থাকে ।
প্রশ্ন:- দুটি অ্যামিনো অ্যাসিডের জীব অণুর নাম কী ?
উত্তর:- দুটি অ্যামিনো অ্যাসিডর জীব অণুর নাম হল ড্যালিন ওলিউসিন ।
প্রশ্ন:- দুটি প্রাকৃতিক পলিমারের নাম লেখো ও এদের মনোমারের নাম কী ?
উত্তর:- দুটি প্রাকৃতিক পলিমারের নাম হল সেলুলোজ ও প্রোটিন। সেলুলোজের মনোমারের নাম হল গ্লুকোজ এবং প্রোটিনের মনোমারের নাম হল অ্যামিনো অ্যাসিড ।
প্রশ্ন:- দুটি উদ্ভিজ্জ জীবজ অণুর নাম কী ?
উত্তর:- দুটি উদ্ভিজ্জ জীবজ অণুর নাম হল শ্বেতসার ওইনিউলিন ।
প্রশ্ন:- দুটি প্রাণীজ জীবজ অণুর নাম কী ?
উত্তর:- দুটি প্রাণীজ জীবজ অণুর নাম হল গ্লাইকোজেন ও অ্যালবুমিন ।
প্রতীক
বর্তমানে পৃথিবীতে মোট ১১৮টি মৌল বা মৌলিক পদার্থ আছে। এদের নামগুলো কিছু এসেছে ল্যাটিন ভাষা থেকে, কিছু এসেছে ইংরেজি ভাষা থেকে। যখন কোনো মৌল সম্পর্কে সংক্ষেপে লিখা হয় তখন কেবল ঐ মৌলের প্রতীককে ব্যবহার করে তা লিখা হয়। তাই মৌলিক পদার্থের ইংরেজি বা ল্যাটিন নামকে সংক্ষিপ্ত ভাবে প্রকাশের চিহ্নকে ঐ মৌলের প্রতীক বলে।
মৌলের প্রতীক লিখতে হলে কিছু নিয়ম অনুসরণ করতে হয়। এই নিয়মগুলো হচ্ছে-
- যদি একটা অক্ষর বা Latter দিয়ে প্রতীক লিখতে হয়, তবে মৌলের ইংরেজি নামের কেবল প্রথম অক্ষর দিয়ে প্রতীক লিখতে হবে এবং প্রথম অক্ষরটি বড় হাতের হবে। যেমন নাইট্রোজেনের প্রতীক N.
- যদি দুইটা অক্ষর বা Latter দিয়ে প্রতীক লিখতে হয়, তবে মৌলের ইংরেজি নামের প্রথম অক্ষর হবে বড় হাতের এবং পরের অক্ষরটি হবে ছোট হাতের। যেমন- ক্যালসিয়ামের প্রতীক Ca.
- কিছু মৌলের প্রতীক তাদের ল্যাটিন নাম থেকে নেওয়া হয়, যেমন- সোডিয়ামের ল্যাটিন নাম Natrium যার সংকেত Na, সিলভারের ল্যাটিন নাম Argentum যার সংকেত Ag।
সংকেত
যখন একটা মৌলিক পদার্থের অণুকে প্রকাশ করা হয় তখন তাকে সংকেতের মাধ্যমে প্রকাশ করা হয়। একইসাথে যদি অনেকগুলো মৌলিক পদার্থ মিলে একটা যৌগিক পদার্থ তৈরি করে তখন সেটাকেও সংকেতের মাধ্যমে প্রকাশ করা হয়।
একটা মৌলিক পদার্থের সংকেতের মাধ্যমে ঐ মৌলিক পদার্থের একটা অণুতে কয়টা পরমাণু আছে সেটার সংখ্যা সম্পর্কে জানা যায়। যেমন হাইড্রোজেনের সংকেত H2, এর মানে হাইড্রোজেনের একটা অণুতে ২টা হাইড্রোজেন পরমাণু থাকে। আবার সালফারের সংকেত S8, এর মানে সালফারের একটা অণুতে ৮ টা সালফার পরমাণু থাকে। এবার আরো কিছু মৌলিক পদার্থের সংকেত জেনে ফেলি-
হিলিয়াম – He
নাইট্রোজেন – N2
অক্সিজেন – O2
ফসফরাস – P5
ক্লোরিন – Cl2
একটা যৌগিক পদার্থের সংকেত বলতে বোঝায় ঐ যৌগে থাকা প্রতিটা মৌলিক পদার্থ কি অনুপাতে আছে সেটার সাংকেতিক প্রকাশকে। যেমন জিংক সালফেটের সংকেত ZnSO4, এই সংকেত থেকে বোঝা যাচ্ছে এই যৌগে জিংকের অনুপাত ১, সালফারের অনুপাত ১, অক্সিজেনের অনুপাত ৪। একইসাথে এই যৌগটি যে তিনটা মৌলিক পদার্থ – জিংক, সালফার, অক্সিজেন দিয়ে তৈরি তাও বোঝা যায়।
চলো আরো কিছু যৌগিক পদার্থের সংকেত শিখি-
অ্যামোনিয়া – NH3
সালফিউরিক এসিড – H2SO4
কপার সালফেট – CuSO4
লেড সালফাইড – PbS
অ্যামোনিয়াম হাইড্রোক্সাইড – NH4OH
ম্যাগনেসিয়াম ক্লোরাইড – MgCl2
জৈব রসায়নে ইউপ্যাক নামকরণ হলো আন্তর্জাতিক ফলিত রসায়ন সংস্থা (ইউপ্যাক) কর্তৃক প্রস্তাবিত পদ্ধতিগত নামকরণ। এই নামকরণের প্রস্তাবনাটি Nomenclature of Organic Chemistry (অনানুষ্ঠানিকভাবে নীল বই বলা হয়) এ প্রকাশিত হয়। আদর্শগতভাবে, প্রত্যেকটি সম্ভাব্য জৈব যৌগের এমন একটি নাম থাকা প্রয়োজন , যা হতে অদ্বৈত গাঠনিক সংকেত বের করা সম্ভব। অজৈব যৌগেরও ইউপ্যাক নামকরণ পদ্ধতি রয়েছে।
সাধারণ যোগাযোগের ক্ষেত্রে দীর্ঘ এবং ক্লান্তিকর নাম এড়াতে বাস্তবে শুধুমাত্র অদ্বৈত এবং পরম সংজ্ঞায়ন ব্যতীত সর্বদা ইউপ্যাক নামকরণ অনুসরণ করা হয় না। কখনো কখনো পূর্বের নামকরণের তুলনায় ইউপ্যাক নামকরণ সহজ হয় (যেমন ইথাইল অ্যালকোহল এর পরিবর্তে ইথানল)। তুলনামূলকভাবে ছোট অণুগুলোর অপদ্ধতিগত নামকরণের চাইতেও এটি সহজ এবং বোধগম্য। তবে সাধারণ অথবা প্রচলিত নামটি তুলনামূলকভাবে সংক্ষিপ্ত এবং তাদের প্রাধান্য দেওয়া হয়। এসব অপদ্ধতিগত নাম প্রায়ই যৌগের মূল উৎস থেকে গৃহীত। আবার অতিদীর্ঘ নামগুলো গাঠনিক সংকেতের তুলনায় কম বোধগম্য হতে পারে।
রসায়নে, যৌগে অবস্থিত বিভিন্ন কার্যকরী মূলকের অবস্থান এবং ধরন বর্ণনা করার জন্য অনেক উপসর্গ ও অনুসর্গ রয়েছে। একটি জৈব যৌগ কে নামকরণ এর ধাপসমূহ হল:
প্রধান কার্বন শিকল চিহ্নিতকরণঃ এক্ষেত্রে অবশ্যই ক্রমানুসারে নিম্নোক্ত নীতি সমূহ অনুসরণ করতে হবে :
1. এতে কার্যকরী মূলকের সর্বোচ্চ সংখ্যক প্রতিস্থাপক থাকতে হবে।
2. যদি একাধিক কার্যকরী মূলক উপস্থিত থাকে তবে সক্রিয়তা ক্রম ব্যবহার করতে হবে।
3. এতে এর সর্বোচ্চ সংখ্যক দ্বিবন্ধন কিংবা ত্রিবন্ধন থাকতে হবে।
4. এতে সর্বোচ্চ সংখ্যক একক বন্ধন থাকতে হবে।
5. এর দৈর্ঘ্য সবচেয়ে বেশি হতে হবে।
সর্বোচ্চ ক্রমানুসারে মূল কার্যকরী মূলক সনাক্তকরণঃ
পার্শ্ব শিকল সনাক্তকরণঃ
পার্শ্বশিকল হল সেসব কার্বন শিকল যেগুলো মূল শিকল নয় কিন্তু এর শাখা। যদি কোন সহকারী কার্যকরী মূলক থাকে, তবে তাদের আয়নিক উপসর্গ অনুসারে নামকরণ (যেমন hydroxy for -OH, oxy for =O, oxyalkane for O-R, ). ইংরেজি বর্ণমালার ক্রমানুসারে বিভিন্ন শাখা শিকল এবং কার্যকরী মূলকগুলো গ্রুপ করা হবে। এক্ষেত্রে সংখ্যা মূলক উপসর্গগুলো বিবেচনা করা হবে না (যেমন ডাই-,ট্রাই- ইত্যাদি)। যখন পার্শ্ব শিকল এবং সহকারী কার্যকরী মূলক উভয়ই উপস্থিত থাকে , তখন তাদেরকে বিভিন্ন গ্রুপে লেখার পরিবর্তে একই গ্রুপে লিখতে হবে।
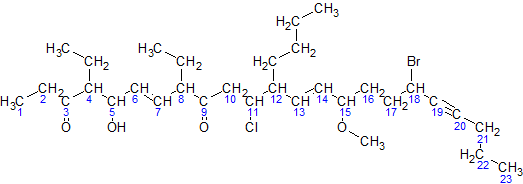
দ্বিবন্ধন এবং ত্রিবন্ধন সনাক্তকরণ শাখাটি ক্রমাংকিতকরণের জন্য প্রথমে শাখাটিকে উভয় দিক (বাম থেকে ডান এবং ডান থেকে বাম) থেকে সংখ্যায়িত করা হয়। অতঃপর নিম্নোক্ত নিয়ম অনুসরণ করে সঠিক সংখ্যায়ন বেছে নেয়া হয় সবচেয়ে নিকটবর্তী কার্যকরী মূলক অর্থাৎ যার সবচেয়ে কাছ থেকে কোন কার্যকরী মূলক সরাসরি যুক্ত রয়েছে যার সবচেয়ে নিকটবর্তী কার্বন এ একাধিক বন্ধন রয়েছে সবচেয়ে নিকটবর্তী কার্বনের কোন প্রতিস্থাপক যুক্ত রয়েছে বিভিন্ন প্রতিস্থাপক এবং বন্ধনকে তাদের কার্বনসংখ্যার ভিত্তিতে সংখ্যায়িতকরণঃ যদি একই ধরনের প্রতিস্থাপক কিংবা দ্বিবন্ধন একাধিক বার থাকে তবে তাদের সংখ্যার ভিত্তিতে উপসর্গ যুক্ত করা হয় ( di – 2 tri – 3 tetra – 4) এই পদ্ধতিতে বিন্যাসকরণ: ধাপ 3 এর প্রস্তুতকৃত সংখ্যায়িত কার্যকরী মূলক এবং পার্শ্ব শিকল + প্রধান শিকলের হাইড্রোকার্বন এর উপসর্গ + সংখ্যাসহ দ্বিবন্ধন/ত্রিবন্ধন (অথবা "ane") + সংখ্যাসহ প্রধান কার্যকরী মূলক সংখ্যা বলতে সংখ্যাসূচক শব্দ বোঝানো হয়েছে। চিহ্ন যোগ: সংখ্যাগুলোর মাঝে কমা ব্যবহৃত হয় (2 5 5 হয়ে যাবে 2,5,5) সংখ্যা এবং বর্ণের মাঝে হাইফেন ব্যবহৃত হয় (2 5 5 trimethylheptane হয়ে যাবে 2,5,5-trimethylheptane) দুটি পাশাপাশি শব্দকে একত্র করা হয় অর্থাৎ মাঝখানে কোনো ফাঁকা স্থান থাকে না (tri heptane হয়ে যায় trimethylheptane) বিঃদ্রঃ ইউপ্যাক সর্বদা এক শব্দ নামকরণ পদ্ধতি অবলম্বন করে। এ কারণে সবগুলো অংশ পরস্পর সংযুক্ত। চূড়ান্ত নামকরণটি এমন দেখাবে: #,#-di<পার্শ্বশিকল>-#-<সহকারী কার্যকরী মূলক>-#-<পার্শ্বশিকল>-#,#,#-tri<সহকারী কার্যকারী মূলক><প্রধান শিকলের অনুসর্গ><যদি সবগুলো বন্ধন একক বন্ধন হয় তবে "ane" যুক্তকরণ>-#,#-di<দ্বিবন্ধন>-#-<ত্রিবন্ধন>-#-<প্রধান কার্যকরী মূলক> বিঃদ্রঃ: # কোন সংখ্যার জন্য ব্যবহৃত হয়েছে। পার্শ্ব শিকল এবং সহকারী কার্যকরী মূলকগুলো দেখানো উপায়ে নাও হতে পারে, কেননা সে গুলোকে বর্ণমালার ক্রমানুসারে সাজাতে হবে। ডাই- এবং ট্রাই- শুধুমাত্র তাদের সংখ্যার জন্য ( #,# এর পর ডাই-, #,#,# এর পর ট্রাই- ইত্যাদি) উদাহরণ প্রধান কার্বন শিকল এর ২৩ টি কার্বন রয়েছে। একে বলা হয় tricosa-। সক্রিয়তা ক্রমানুসারে প্রধান কার্যকারী মুলক দুটো কিটোন মূলক মূলক গুলো 3 নং এবং 9 নং কার্বন এর সাথে সংযুক্ত। যেহেতু দুটি রয়েছে তাই লেখা হবে 3,9-dione. কিটোন মূলক অনুসারে যৌগটির সংখ্যায়ন করা হবে। যখন বাম থেকে ডানে সংখ্যায়িত করা হয় কিটোন মূলক গুলো 3 এবং 9 নং কার্বন থাকে। কিন্তু যখন ডান থেকে বামে সংখ্যায়িত করা হয় তখন কিটোন মূলক গুলো 15 এবং 21 নং কার্বন থাকে। যেহেতু 3, 15 এর চেয়ে ছোট তাই কিটোন মূলক গুলো 3 এবং 9 সংখ্যায়িত করা হবে। লক্ষনীয় যে ক্ষুদ্রতর সংখ্যাটি ব্যবহৃত হয়, সংখ্যাগুলোর সমষ্টি নয়। পার্শ্ব শিকল সমূহ হলো: 4 নং কার্বনে একটি ethyl- , 8 নং কার্বনে একটি ethyl- এবং 12 নং কার্বনে একটি butyl- বিঃদ্রঃ 15 নং কার্বনের -O-CH3 টি কোন পার্শ্বশিকল নয় বরং এটি মিথোক্সি মুলক দুটি ইথাইল মূলক রয়েছে তাই এদেরকে সংযুক্ত করে পাই 4,8-diethyl। পার্শ্ব শিকল গুলোকে গ্রুপ করা হয়: 12-butyl-4,8-diethyl। তবে এটি চূড়ান্ত নয়, কেননা আরো কার্যকরী মূলক যুক্ত হতে পারে (এবং নিশ্চিত করতে হবে যে এরা বর্ণানুক্রমিকভাবে সাজানো হয়েছে)। সহকারী কার্যকরী মূলক গুলো হল: 5 নং কার্বনের একটি হাইড্রক্সি, 11 নং কারণে একটি ক্লোরো, 15 নং কারণে একটি মিথোক্সি এবং 18 নং কার্বন এ একটি ব্রোমো। পার্শ্ব শিকলের সঙ্গে গ্রুপ করে পাওয়া যায় 18-bromo-12-butyl-11-chloro-4,8-diethyl-5-hydroxy-15-methoxy দুটি দ্বিবন্ধন রয়েছে - একটি 6 নং এবং 7 নং কার্বনে এবং অপরটি 13 নং ও 14 নং কার্বনে: এদেরকে বলা হবে "6,13-diene", 19 নং ও 20 নং কার্বনের একটি ত্রিবন্ধন রয়েছে। একে বলা হবে 19-yne। চিহ্ন সহকারে বিন্যাস টি হলো: 18-bromo-12-butyl-11-chloro-4,8-diethyl-5-hydroxy-15-methoxytricosa-6,13-dien-19-yne-3,9-dione সর্বশেষে সিস-ট্রান্স সমানুতার কারণে প্রত্যেকটি দ্বিবন্ধন এর সাপেক্ষে কার্যকরী মূলকের অবস্থান উল্লেখ করতে হবে। এই উদাহরণ এর জন্য এটি (6E,13E) সে ধরনের পার্শ্বশিকলে অবস্থিত প্রতিস্থাপকের সংখ্যায়ন পার্শ্বশিকলের নামের পূর্বে অবরোহী পদ্ধতিতে লেখা হয়। একই আলফা কার্বন বিশিষ্ট দুটি পার্শ্বশিকল থাকলে সংখ্যাটি দুইবার লেখা হয়, যেমন: 2,2,3-trimethyl-। যদি দ্বিবন্ধন এবং ত্রিবন্ধন উভয় থাকে তবে "yne" (ত্রিবন্ধন) এর পূর্বে "en" (দ্বিবন্ধন) লেখা হয়। যদি প্রধান কার্যকরী মূলক সমাপ্তি কার্যকরী মূলক (যে মূলক শুধু মাত্র শিকলের শেষে অবস্থান করে, যেমন কার্বক্সিল মূলক, ফর্মাইল মূলক) হয় তবে এতে সংখ্যায়নের প্রয়োজন নেই।
এখানে প্রধান কার্বন সংখ্যায়িত একটি যৌগের নামকরণ দেখানো হলো:
জটিলতা পরিহারের জন্য প্রধান শিকলে হাইড্রোজেন গুলো অপসারণ এবং কার্বন গুলো দেখিয়ে একই যৌগের নামকরণ দেখানো হলো
এখন উপরোক্ত নিয়মাবলী অনুসরণ করে:
অবশেষে নামকরণটি হলো (6E,13E)-18-bromo-12-butyl-11-chloro-4,8-diethyl-5-hydroxy-15-methoxytricosa-6,13-dien-19-yne-3,9-dione।
বেনজিন
বেনজিন কম গলনাঙ্ক বিশিষ্ট কঠিন পদার্থ অথবা তরল। আণবিক ভর বৃদ্ধির সাথে তরলের স্ফুটনাঙ্ক বৃদ্ধি পায়।বেনজিনে ইলেকট্রফিলিক সংযোজন বিক্রিয়া ঘটে। বেনজিনে বহু-প্রতিস্থাপন বিক্রিয়া ঘটে। বেনজিন বলয়ে প্রতিস্থাপক দুই প্রকার হতে পারে। যথা:
- অর্থো-প্যারা নির্দেশক গ্রুপ
- মেটা নির্দেশক গ্রপ
বেনজিনের রেজোন্যান্স বা অনুরণন ধর্ম আছে।
দ্রাব্য: Acetone, অ্যালকোহল, ক্লোরোফরম, অ্যাসিটিক এসিড, Carbon tetrachloride, Diethyl ether
শুধুমাত্র হাইড্রোজেন ও কার্বন দ্বারা গঠিত জৈব যৌগকে হাইড্রোকার্বন বলে। হাইড্রোকার্বন বিভিন্ন ধরনের হতে পারে, যেমন সম্পৃক্ত হাইড্রোকার্বন অ্যালকেন, অসম্পৃক্ত হাইড্রোকার্বন অ্যালকিন ও অ্যালকাইন, ও অ্যারোম্যাটিক হাইড্রোকার্বন।
শ্রেণিবিভাগ:
ইউপ্যাক-এর জৈব যৌগ নামকরণ পদ্ধতি অনুসারে হাইড্রোকার্বনগুলিকে নিম্নলিখিত শ্রেণিতে ভাগ করা যায়ঃ
- সম্পৃক্ত হাইড্রোকার্বনঃ এই ধরনের হাইড্রোকার্বনের (অ্যালকেন) সাধারণ সূত্র CnH2n+2। এই যৌগে কার্বন ও হাইড্রোজেন শুধুমাত্র একবন্ধন দ্বারা যুক্ত এবং একটিমাত্র শৃঙ্খলে বা শাখাযুক্ত শৃঙ্খলে সজ্জিত। পেট্রোলি্য়াম জাতীয় জৈব জ্বালানির মুখ্য উপাদান সম্পৃক্ত হাইড্রোকার্বন। কার্বন শৃঙ্খল ও শাখার দৈর্ঘ্যের উপর ভিত্তি করে সম্পৃক্ত হাইড্রোকার্বনে আইসোমেরিজম ও কাইরালিটি দেখা যেতে পারে।
- অসম্পৃক্ত হাইড্রোকার্বনঃ এই শ্রেণিতে কার্বন-কার্বন ও কার্বন-হাইড্রোজেন একবন্ধনের পাশাপাশি কার্বন-কার্বন দ্বিবন্ধন ও ত্রিবন্ধন বিদ্যমান। একটি দ্বিবন্ধন যুক্ত হাইড্রোকার্বনের সাধারণ সূত্র CnH2n (অ্যালকিন) ও একটি ত্রিবন্ধন যুক্ত হাইড্রোকার্বনের সাধারণ সূত্র CnH2n-2 (অ্যালকাইন)।
- বলয়াকার (সাইক্লিক) হাইড্রোকার্বনঃ এই ধরনের যৌগে এক বা একাধিক কার্বন বলয় উপস্থিত। একটি বলয় বিশিষ্ট সম্পৃক্ত বলয়াকার হাইড্রোকার্বনের সাধারণ সংকেত CnH2n।
- অ্যারোম্যাটিক হাইড্রোকার্বনঃ এই শ্রেণির হাইড্রোকার্বনে এক বা একাধিক অ্যারোম্যাটিক বলয় (অ্যারোম্যাটিক রিং) থাকে। অ্যারোম্যাটিক হাইড্রোকার্বনের সবচেয়ে উল্লেখযোগ্য উদাহরণ হল বেঞ্জিন।