খনিজ সম্পদ- ধাতু ও অধাতু
বাংলাদেশের নেত্রকোনা জেলার দুর্গাপুর উপজেলার বিজয়পুর, গোপালপুর অন্যতম পর্যটন কেন্দ্র। এখানে নয়নাভিরাম লেকের পাশে সাদা মাটির পাহাড় দেখা যায়। কেওলিন বা অ্যালুমিনিয়াম সমৃদ্ধ এই মাটি সিরামিক কারখানায় ব্যবহৃত হয়। শুরুতে চীন দেশের লোকেরা এই রকম মাটি ব্যবহার করতো বলে এই মাটিকে চীনা মাটি বা চায়না ক্লে বলা হয়। সচরাচর কালো বা ধূসর এবং লাল মাটি দেখা যায়। প্রতি ক্ষেত্রে মাটির বৈশিষ্ট্য ভিন্ন ভিন্ন। এই ভিন্নতার কারণ মাটিতে বিভিন্ন খনিজের উপস্থিতি।
ভূ-ত্বকের উপাদান
ভূ-ত্বকের উপাদান

প্রকৃতিতে ধাতু
প্রকৃতিতে সক্রিয় ধাতুসমূহের যৌগ প্রচুর পরিমাণে পাওয়া যায়। অপরপক্ষে কম সক্রিয় ধাতুর যৌগ
খুব কম পাওয়া যায়। ফলে কম সক্রিয় ধাতু যেমন, সিলভার (Ag), কপার (Cu) , জিংক (Zn) , টিন (Sn) এবং লেড(Pb) ইত্যাদি মূল্যবান। নিষ্ক্রিয় ধাতু যেমন স্বর্ণকে (Au) প্রকৃতিতে মুক্ত অবস্থায় পাওয়া গেলেও তা প্রায় বিরল। এ জন্য স্বর্ণ অত্যন্ত মূল্যবান। প্রকৃতিতে পাওয়া যায় এমন ৯৮ টি মৌলের চার ভাগের তিন ভাগই ধাতু।
ধাতুর বৈশিষ্ট্য
ধাতুর বৈশিষ্ট্যসমূহ হলো-
ক. ঘাতসহনীয়তা (ধাতুকে পিটিয়ে যে কোন আকার দেয়া যায়)
খ. নমনীয়তা (ধাতুকে পিটিয়ে সরু তারে পরিণত করা যায়)
গ. উজ্জ্বলতা (ধাতুর বিশেষ দ্যুতি আছে। এরা আলোক বিচ্ছুরণ করে)
ঘ. পরিবাহিতা (ধাতুসমূহ তাপ ও বিদ্যুৎ সু-পরিবাহী)
ঙ. ধাতব শব্দ (আঘাতে ধাতু টুন টুন শব্দ করে)
চ. গলনাংক ও স্ফুটনাংক (ধাতু উচ্চ গলনাংক ও স্ফুটনাংক বিশিষ্ট)
ছ. ঘনত্ব (ধাতুসমূহের ঘনত্ব আধাতুর তুলনায় বেশি)।
প্রকৃতিতে অধাতু
প্রকৃতিতে ধাতুর মত অধাতুসমূহও যৌগ হিসেবে অবস্থান করে। তবে কোনো কোনো অধাতু যেমন, সালফার মুক্ত মৌল হিসেবে পাওয়া যায়।
শিলা
অধিকাংশ শিলা কতগুলো শক্ত কণার মিশ্রণে সৃষ্টি হয়েছে। বিভিন্ন খনিজ পদার্থ মিশ্রিত হয়ে এই কণাগুলো তৈরি হয়েছে। শিলা সবসময় এক রকম থাকে না। আবহাওয়ার সাথে সাথে অর্থাৎ তাপমাত্রা, বৃষ্টি, কুয়াশা, ঝড়, বায়ু প্রবাহ ইত্যাদির কারণে শিলা ক্ষয়প্রাপ্ত হয়। চুনাপাথর (ক্যালসিয়াম কার্বনেট) বৃষ্টির পানিতে ধুয়ে সাগরে যায়। সেখানে তলানি জমে চুনা পাথর ও বেলে পাথর সৃষ্টি হয়। তলানি বিভিন্ন স্তরে জমা হয়। এজন্য শিলাতে বিভিন্ন স্তর দেখা যায় । টিলা বা পর্বত ছড়াতেও তুমি বিভিন্ন স্তর দেখতে পাবে। সিমেন্ট জাতীয় পদার্থ ক্যালসিয়াম কার্বনেট ক্ষুদ্র কণাগুলোকে শক্ত করে ধরে রেখে পাথর বা শিলায় পরিণত করে। এই শিলা পাললিক শিলা। মৃত সামুদ্রিক প্রবাল বা ঝিনুক-শামুকের খোসা তলানিতে জমে চুনাপাথরে পরিণত হয়। কোনো কোনো শিলা ভূগর্ভের অনেক গভীরে থাকে। ভূগর্ভের উচ্চ তাপে শিলা গলে যায়। এই গলিত অবস্থাকে ম্যাগমা বলে। ম্যাগমা ঠাণ্ডা হলে পুনরায় কঠিন শিলায় পরিণত হয়। এই শিলাকে আগ্নেয় শিলা বলে। এই শিলাগুলোতে অনেক সময় মূল্যবান খনিজ সম্পদ পাওয়া যায়। আবার কখনো তা কেবলই বেলে পাথর।
খনিজ
মূল্যবান ধাতু ও অধাতুসমূহ পৃথিবীর সর্বত্র বিরাজিত থাকলেও ভূপৃষ্ঠে বা ভূগর্ভে কোনো কোনো শিলাস্তূপে প্রচুর পরিমাণে যৌগ অথবা মুক্ত মৌল হিসেবে মূল্যবান ধাতু বা অধাতু পাওয়া যায়। এগুলোকে খনিজ বলে। খনিজ পদার্থ বিভিন্ন অর্থে বিভিন্ন প্রকারের। মৌল ও যৌগ বিবেচনায় খনিজ পদার্থ দুই প্রকার। যথা : মৌলিক খনিজ ও যৌগিক খনিজ।
মৌলিক খনিজ : স্বর্ণ, হীরা, গন্ধক, ইত্যাদি পদার্থকে প্রকৃতিতে মৌলিক পদার্থ রূপে পাওয়া যায়। এ জন্য এগুলো মৌলিক খনিজ।
যৌগিক খনিজ : মৌলিক খনিজ বাদ দিলে বাকি সকল খনিজ যৌগিক খনিজ। এদেরকে যৌগ হিসেবে পাওয়া যায়।
ভৌত অবস্থা বিবেচনায় খনিজ তিন প্রকার। যথা, ১. কঠিন খনিজ, ২. তরল খনিজ ও ৩. গ্যাসীয় খনিজ।
কঠিন খনিজ : কঠিন অবস্থায় পাওয়া যায়। যেমন, ম্যাগনেটাইট , বক্সাইট , সালফার বা গন্ধক ইত্যাদি ।
তরল খনিজ : মার্কারি বা পারদ , পেট্রোলিয়াম ।
গ্যাসীয় খনিজ : প্রাকৃতিক গ্যাস।
খনিজ সম্পদের অবস্থান
পূর্বে ভূগর্ভকে খনিজ পদার্থের উৎস হিসেবে কল্পনা করা হতো। কিন্তু এ ধারণাকে আর সঠিক বলা যাচ্ছে না।
নেত্রকোনার বিজয় পুরের সাদা মাটি বা কেওলিন ভূপৃষ্ঠে টিলা রূপে বিদ্যমান। কক্সবাজার সমুদ্র উপকূলের বালি থেকে জিরকন-জিরকোনিয়ামের আকরিক, রুটাইল-টাইটানিয়ামের আকরিক এবং মোনাজাইট-থোরিয়ামের আকরিক ইত্যাদি মূল্যবান খনিজ আহরণ করা হয়। লোহা বা আয়রনের খনিজ-হেমাটাইট, অ্যালুমিনিয়ামের খনিজ-বক্সাইট বা কয়লার মতো খনিজ ভূত্বকে পাওয়া যায়। আবার অনেক খনিজ আহরণের জন্য গর্ত খুঁড়ে ভূত্বকের অনেক গভীরে যেতে হয়।
কার্বন বিজারণ
অনেক ধাতুর আকরিক ধাতব অক্সাইড এবং এই ধাতব অক্সাইডকে কার্বনসহ তাপ দিলে ধাতু মুক্ত হয় । এই প্রক্রিয়াকে কার্বন বিজারণ বলে । কার্বন অক্সিজেনের সাথে যুক্ত হয়ে কার্বন-ডাই-অক্সাইড উৎপন্ন করে । যেমন,

এ প্রক্রিয়াকে স্মেল্টিং বা আকরিক গলিয়ে ধাতু নিষ্কাশন বলা হয় ।
ধাতু বিশোধন
খনিজমল দূর করার জন্য আকরিকের সাথে ফ্লাক্স বা বিগালক যোগ করা হয় । উচ্চ তাপমাত্রায় ধাতব অক্সাইড বিজারিত হয়ে ধাতু মুক্ত হয় এবং ফ্লাক্স খনিজমলের সাথে যুক্ত হয়ে ধাতুমল উৎপন্ন করে । ধাতুমল গলিত ধাতুতে দ্রবীভূত হয় না । অপেক্ষাকৃত হালকা বলে গলিত ধাতুমলকে সহজেই পৃথক করা যায় । এ প্রক্রিয়াকে বিগলন বলে ।
তড়িৎ বিশোধন
বিগলন প্রক্রিয়ায় প্রাপ্ত ধাতুকে আরো বিশুদ্ধ করার জন্য তড়িৎ বিশোধন করা হয় । যেমন, বিগলন প্রক্রিয়ায় উৎপন্ন তামা 98% বিশুদ্ধ হয় । এই তামাকে তড়িৎবিশ্লেষণ করলে 99.9% বিশুদ্ধ কপার বা তামা পাওয়া যায় । তড়িৎবিশ্লেষণে তড়িৎ শক্তি ব্যবহার করে রাসায়নিক বিক্রিয়া সংগঠন করা হয় ।
ধাতু সংকর
ধাতু উপাদান ও সংযুক্তি ব্যবহার
স্টিল লোহা 99% রেলের লাইন,ইঞ্জিন,জাহাজ,যানবাহন,
, কার্বন 1% ক্রেইন,যুদ্ধাস্ত্র, ছুরি,কাঁচি,ঘড়ির স্প্রিং, চুম্বক,কৃষি যন্ত্রপাতি ইত্যাদি ।
স্টেইনলেস স্টিল লোহা 74% ছুরি,কাটাচামচ,পাকঘরের সিঙ্ক,রসায়ন
ক্রোমিয়াম 18% শিল্পের বিক্রিয়া পাত্র,অস্ত্রোপাচারের
নিকেল 8% যন্ত্রপাতি
পিতল(ব্রাস) কপার 65% অলঙ্কার,বিয়ারিং,বৈদ্যুতিক সুইচ,দরজার
জিংক 35% হাতল, ডেগ পাতিল ইত্যাদি ।
কাসা(ব্রোঞ্জ) কপার 90% ধাতু গলানো, যন্ত্রাংশ, থালা, গরাস
টিন 10%
ডুরালামিন আ্যলুমিনিয়াম 95% উড়োজাহাজের বডি, বাইসাইকেলের
কপার 4% পার্টস ইত্যাদি ।
ম্যাগনেসিয়াম,ম্যাঙ্গানিজ
ও্ লোহা 1%
স্বর্ণ 24 ক্যারট; 100% স্বর্ণ অলংকার তৈরিতে ব্যবহৃত হয় ।
21 ক্যারট; 87.5% স্বর্ণ, 12.5%
কপারসহ অন্যান্য ধাতু
22 ক্যারট; 91.67% স্বর্ণ, 8.33%
কপারসহ অন্যান্য ধাতু
ধাতুক্ষয়
সাধারণত সক্রিয় ধাতুসমূহ দ্রুত ক্ষয় হয় । নতুন তামা বা কপারের বর্ণ গোলাপী বা তামাটে । কিছুদিন রেখে দিলে কপারের বর্ণ বাদামী হয়ে যায় । কারণ এর উপর কপার অক্সাইডের আবরণ পরে । তুমি নিশ্চয় তামা ও পিতলের তৈরী পাতিল ও মসজিদ-মন্দিরের নকশা দেখেছ । কিছুদিন পরিষ্কার করা না হলে এর উপরে সবুজ বর্ণের তাম্রমলের আবরণ পরে । এটি এক প্রকার কপার লবণ । তাম্রমল সাধারণত কপার কার্বনেট ও কপার হাইড্রক্সাইডের মিশ্রণ ( ) । তাম্রমল জৈব এসিডে দ্রবীভূত হয় । তাই জৈব এসিড সমৃদ্ধ ফল দিয়ে এদের পরিষ্কার করলে সোনালী সৌন্দর্য ফেরত পায় । স্বর্ণ ও প্লাটিনাম নিষ্ক্রিয় । হাজার বছরেও এগুলো ক্ষয় হয় না ।
) । তাম্রমল জৈব এসিডে দ্রবীভূত হয় । তাই জৈব এসিড সমৃদ্ধ ফল দিয়ে এদের পরিষ্কার করলে সোনালী সৌন্দর্য ফেরত পায় । স্বর্ণ ও প্লাটিনাম নিষ্ক্রিয় । হাজার বছরেও এগুলো ক্ষয় হয় না ।
ফ্রাশ পদ্ধতি
সালফারের খনি মাটির অনেক গভীরে থাকে । খনি থেকে আহরনের জন্য তিনটি এককেন্দ্রিক নল সালফার স্তরের গভীরে প্রবেশ করানো হয় । সর্ববহিঃস্থ নল দিয়ে উচ্চ চাপে 180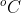 তাপমাত্রায় জলীয়বাষ্প প্রবেশ করানো হয় । সালফারের গলনাংক 119
তাপমাত্রায় জলীয়বাষ্প প্রবেশ করানো হয় । সালফারের গলনাংক 119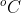 বলে তা জলীবাষ্পের প্রভাবে গলে যায় । কেন্দ্রীয় নলটি দিয়ে উচ্চচাপে গরম বায়ু প্রবেশ করানো হয় । চাপের প্রভাবে মাঝখানের নল দিয়ে সালফার বেরিয়ে আসে । একে ফ্রাশ পদ্ধতি বলে ।
বলে তা জলীবাষ্পের প্রভাবে গলে যায় । কেন্দ্রীয় নলটি দিয়ে উচ্চচাপে গরম বায়ু প্রবেশ করানো হয় । চাপের প্রভাবে মাঝখানের নল দিয়ে সালফার বেরিয়ে আসে । একে ফ্রাশ পদ্ধতি বলে ।
সালফারের ব্যবহার
রসায়ন শিল্পের প্রধান কাঁচামাল সালফিউরিক এসিড সালফার থেকে প্রস্তুত করা হয় । রাবার ভলকানাইজিং, সালফাড্রাগ, দিয়াশলাই, বারুদ ও ফটোগ্রাফীতে ব্যবহৃত হাইপোসহ বিভিন্ন অত্যাবশকীয় যৌগ প্রস্তুতিতে সালফার ব্যবহৃত হয় ।
স্পর্শ পদ্ধতি
স্পর্শ চেম্বারে 400-450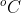 তাপমাত্রায় প্লাটিনাম চূর্ণ বা ভ্যান্ডিয়াম পেন্টাঅক্সাইডের উপস্থিতিতে সালফার অক্সিজেন দ্বারা জারিত হয়ে সালফার ট্রাই অক্সাইডে পরিণত হয় ।
তাপমাত্রায় প্লাটিনাম চূর্ণ বা ভ্যান্ডিয়াম পেন্টাঅক্সাইডের উপস্থিতিতে সালফার অক্সিজেন দ্বারা জারিত হয়ে সালফার ট্রাই অক্সাইডে পরিণত হয় ।

সালফার ট্রাই অক্সাইডের সাথে পানি যোগ করলে সালফিউরিক এসিড উৎপন্ন হয় । কিন্তু এতে সমস্যা হল সালফার ট্রাই অক্সাইড বাতাসের জলীয়বাষ্পের সাথে যুক্ত হয়ে সালফিউরিক এসিডের ঘন কুয়াশা সৃষ্টি করে যা ঘনীভূত করা আত্যন্ত কঠিন ।

তাই  কে 98%
কে 98% 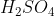 এ শোষণ করে ধূমায়মান সালফিউরিক এসিড তৈরী করা হয় । একে ওলিয়াম বলে । ওলিয়ামকে পানির সাথে প্রয়োজনমত মিশ্রিত করে লঘু করা হয় ।
এ শোষণ করে ধূমায়মান সালফিউরিক এসিড তৈরী করা হয় । একে ওলিয়াম বলে । ওলিয়ামকে পানির সাথে প্রয়োজনমত মিশ্রিত করে লঘু করা হয় ।


আকরিক
ধাতু আকরিক
মার্কারী সিন্নাবার 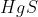
জিংক জিংক ব্লেন্ড 
ক্যালামাইন 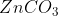
লেড গ্যালেনা 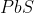
আয়রন ম্যাগনেটাইট 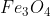
হেমাটাইট 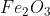
লিমোনাইট 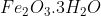
কপার কপার পাইরাইট 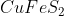
চেলকোসাইট 
আ্যলুমিনিয়াম বক্সাইট 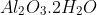
সোডিয়াম সাগরের পানি 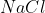
ক্যালসিয়াম চুনাপাথর 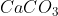
চৌম্বক ধর্ম বিশিষ্ট আকরিক
আকরিক বা খনিজমলের কোন একটির যদি চৌম্বকধর্ম থাকে তাহলে চৌম্বকীয় পৃথকীকরণ ব্যবহার করা হয় । ক্রোমাইট ( ), উলফ্রামাইট(
), উলফ্রামাইট( ), রুটাইল(
), রুটাইল( ) ইত্যাদি চৌম্বক ধর্ম বিশিষ্ট আকরিক ।
) ইত্যাদি চৌম্বক ধর্ম বিশিষ্ট আকরিক ।





